TP3 SISTEMAS MATERIALES
Página 1 de 1.
 TP3 SISTEMAS MATERIALES
TP3 SISTEMAS MATERIALES
DOCENTE: DANIEL CORIA
SISTEMAS MATERIALES
Sistemas Materiales: son aquellos cuerpos, parte de cuerpos o conjuntos de cuerpos que se aíslan del entorno para su posterior análisis. Básicamente hay 2 tipos de sistemas materiales. Homogéneos y Heterogéneos.
Homogéneos: Son los sistemas materiales que tienen las mismas propiedades intensivas en toda su masa (más adelante se encuentra la explicación de propiedades intensivas). En estos sistemas vemos una continuidad en todos sus puntos. Es decir, no observamos cambios de ninguna índole. Ejemplos: Un vaso con agua. En su contenido solo vemos agua. Agua con sal disuelta: También es homogéneo. Agua y alcohol: Es homogéneo ya que ambos líquidos son miscibles, es decir, se mezclan entre sí. Por lo tanto no se observan discontinuidades. Están formados por una sola fase.
Heterogéneos: En estos sistemas se ven discontinuidades en sus propiedades intensivas. Ejemplos: Agua y arena: La arena es depositada en el fondo del recipiente y se diferencia del agua que queda en la parte superior. Agua y Aceite: El aceite queda en la parte de arriba por su menor densidad, y al ser inmiscible con el agua, esta queda en la parte inferior. La separación se ve marcadamente por una línea continua. Obviamente estas no se ven en los sistemas homogéneos. En muchos ejercicios de este tema preguntan sobre la cantidad de fases, la cantidad de componentes y el tipo de sistema que constituyen algunos sistemas materiales. Veremos algunos ejemplos. Agua, aceite y alcohol: En este caso estamos en presencia de un sistema heterogéneo, con dos fases (Aceite por un lado y agua y alcohol por otro) y tres componentes, agua, aceite y alcohol. Agua y hielo: Tenemos dos fases (agua líquida y hielo) y un solo componente que es el agua.
Bebida gaseosa: Podemos tomar a la bebida en si como un solo componente y al gas que es el CO2 como el otro. Y dos fases, la líquida y la gaseosa determinada por las burbujas.
Propiedades intensivas y Extensivas
Propiedades Intensivas: Son aquellas que no varían con la cantidad de materia. Por ejemplo, el punto de ebullición y de fusión de un líquido. Si sometemos al agua al calor, hervirá a 100°C a presión normal. No importa que calentemos un litro de agua o 3 litros de agua. Su Punto de ebullición no variara. Lo mismo sucederá cuando congelemos al agua. Empezará a congelar a 0°C independientemente de la cantidad que usemos. Otras propiedades intensivas conocidas son, la densidad, el peso específico, etc.
Propiedades Extensivas: Son las propiedades que si dependen de la cantidad de materia. Por Ejemplo: El volumen, el peso, la longitud, etc. a mayor cantidad de materia, estas aumentan.
Separación de fases: Hay métodos para separar fases en los sistemas heterogéneos. A continuación vamos a detallar algunos.
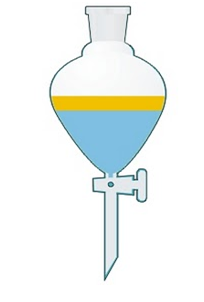
Decantación: Este método utiliza como principio la diferencia de densidades entre 2 sustancias. Por ejemplo, si queremos separar agua de arena o de otro sólido, vertemos el líquido lentamente de un recipiente a otro quedando la arena en el fondo. En el caso de dos líquidos de distintas densidades e inmiscibles como el agua y el aceite, usamos la ampolla de decantación. Es un dispositivo como muestra la figura. En la parte superior esta un receptáculo para colocar los líquidos. Más abajo tiene un vástago provisto de una mariposa que puede cerrar o abrir el flujo de los líquidos. Para recoger a estos se coloca en la parte inferior un vaso de precipitado. Caerá primero al líquido de mayor densidad que se encuentra en la parte inferior. En este ejemplo, el agua. Cuando el agua caiga por completo cerramos la mariposa y quedara el agua en el vaso y el aceite en la ampolla, ambos líquidos completamente separados
Filtración: Es para separar un sólido de un líquido. Especialmente si el sólido consta de partículas pequeñas difíciles de separar por decantación. Consta de un embudo con un papel de filtro en su interior o algodón algunas veces. El contenido se vierte por la parte superior y por gravedad el líquido ira cayendo y atravesando el filtro mientras que los sólidos quedaran retenidos en el filtro

Tamización: Es una especie de filtración. Pero se usa más para separar sólidos pequeños de sólidos grandes. Por ejemplo arena de canto rodado. Generalmente tienen forma de rectángulo de madera con malla metálica en su interior. Centrifugación: Este método usa la velocidad de centrifugación para acelerar la separación de las partículas sólidas o semisólidas del líquido. Están equipadas de un motor rotatorio, de una tapa y de unos controles para regular la velocidad y el tiempo de centrifugación.

Levigación: No es ya un método muy utilizado. Se lo usaba para recuperar por arrastre de una corriente de agua las partículas que vayan precipitando y siendo recogidas posteriormente. Fue un método practicado para recolectar piedritas de oro.
Imantación: Es justificado cuando hay presencia de metales en el sistema heterogéneo como limaduras de hierro.
Tría: consiste en tomar con pinzas o con la mano las fases sólidas y de tamaño adecuadoque están dispersas en otro sólido o en un líquido.
Flotación: consiste en agregar al sistema formado por dos sólidos, un líquido de peso específico intermedio que no altere las sustancias.
Disolución: permite separar las fases de un sistema material utilizando la diferente solubilidad de las mismas en un disolvente adecuado.
Fraccionamiento de Fases: Luego de la separación de fases a veces es necesario separar los componentesque forman dicha fase o el sistema homogéneo que constituye. Esto se denomina métodos de fraccionamiento.
Destilación: Básicamente hay dos tipos de destilación. La simple y la fraccionada.
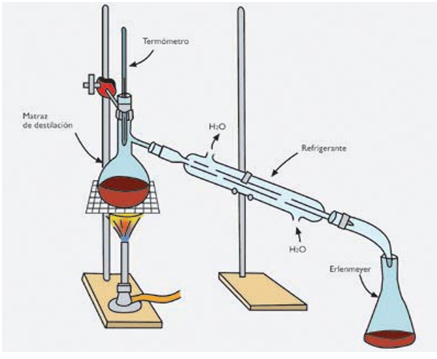
Destilación simple: Consiste en la separación de los sólidos de un líquido, que no se pueden separar normalmente por otros métodos. Los sólidos están compuestos de partículas muy pequeñas. El caso más común es cuando tenemos que separar la sal del agua. El dispositivo consta de un balón de destilación donde se coloca el líquido a destilar. Abajo está el mechero que le da calor para que el líquido entre en ebullición. En el balón hay un tapón de goma, el cual está atravesado por un termómetro para controlar la temperatura del proceso. También está adosado un tubo refrigerante. Cuando el vapor asciende al atravesar el refrigerante se vuelve a enfriar, ya que por este circula una corriente de agua en sentido contrario. El vapor frío pasa nuevamente al estado líquido (condensación), recolectándose de a gotas en un frasco colector (puede ser un erlenmeyer). La sal queda como residuo en el fondo del balón.
Esquema del dispositivo:
Destilación fraccionada: Este tipo de destilación es aplicada para separar líquidos de punto de ebullición cercano. Por ejemplo agua y alcohol. A diferencia de la destilación simple se utiliza una columna de fraccionamiento, ésta permite separar los líquidos, ya que el líquido más volátil (el de menor punto de ebullición) arrastra al de mayor punto de ebullición, lo que hace la columna es producir un enfriamiento y que el líquido menos volátil vuelva al balón y el más volátil siga su camino.
Cromatografía: Es una proceso complejo por su variación en cuanto a los distintos tipos de cromatografía. Pero en general podemos decir que consta de dos fases, una móvil y otra estacionaria. La móvil pasa sobre la estacionaria que generalmente es sólida. La móvil es un fluido que puede ser gas o líquido y que transporta a los componentes a separar. En el transcurso del camino recorrido, los distintos componentes de la mezcla se ven separando y asi permiten que sean identificados. Hoy en día hay dispositivos de alta tecnología que acortan los tiempos y lo más importantes son enormemente exactos en la separación.
Cristalización: Algunas sustancias pueden separarse cuando están en solución formando cristales. Esto depende del tipo de solvente usado y de las temperaturas. Los cristales (soluto) empiezan a formarse por la evaporación del solvente.
CUESTIONARIO:
1_ Definir sistema homogéneo y heterogéneo. Dar ejemplos
2_Definir componente, fase e interfase.
3_ Definición y diferencias que existen entre las propiedades intensivas y extensivas?
4_ Explicar y dibujar los distintos métodos separativos de los siguientes sistemas materiales.
A) Limaduras de hierro- arena- sal- telgopor. (en caso de ser necesario agregar agua)
B) Agua-aceite.
SISTEMAS MATERIALES
Sistemas Materiales: son aquellos cuerpos, parte de cuerpos o conjuntos de cuerpos que se aíslan del entorno para su posterior análisis. Básicamente hay 2 tipos de sistemas materiales. Homogéneos y Heterogéneos.
Homogéneos: Son los sistemas materiales que tienen las mismas propiedades intensivas en toda su masa (más adelante se encuentra la explicación de propiedades intensivas). En estos sistemas vemos una continuidad en todos sus puntos. Es decir, no observamos cambios de ninguna índole. Ejemplos: Un vaso con agua. En su contenido solo vemos agua. Agua con sal disuelta: También es homogéneo. Agua y alcohol: Es homogéneo ya que ambos líquidos son miscibles, es decir, se mezclan entre sí. Por lo tanto no se observan discontinuidades. Están formados por una sola fase.
Heterogéneos: En estos sistemas se ven discontinuidades en sus propiedades intensivas. Ejemplos: Agua y arena: La arena es depositada en el fondo del recipiente y se diferencia del agua que queda en la parte superior. Agua y Aceite: El aceite queda en la parte de arriba por su menor densidad, y al ser inmiscible con el agua, esta queda en la parte inferior. La separación se ve marcadamente por una línea continua. Obviamente estas no se ven en los sistemas homogéneos. En muchos ejercicios de este tema preguntan sobre la cantidad de fases, la cantidad de componentes y el tipo de sistema que constituyen algunos sistemas materiales. Veremos algunos ejemplos. Agua, aceite y alcohol: En este caso estamos en presencia de un sistema heterogéneo, con dos fases (Aceite por un lado y agua y alcohol por otro) y tres componentes, agua, aceite y alcohol. Agua y hielo: Tenemos dos fases (agua líquida y hielo) y un solo componente que es el agua.
Bebida gaseosa: Podemos tomar a la bebida en si como un solo componente y al gas que es el CO2 como el otro. Y dos fases, la líquida y la gaseosa determinada por las burbujas.
Propiedades intensivas y Extensivas
Propiedades Intensivas: Son aquellas que no varían con la cantidad de materia. Por ejemplo, el punto de ebullición y de fusión de un líquido. Si sometemos al agua al calor, hervirá a 100°C a presión normal. No importa que calentemos un litro de agua o 3 litros de agua. Su Punto de ebullición no variara. Lo mismo sucederá cuando congelemos al agua. Empezará a congelar a 0°C independientemente de la cantidad que usemos. Otras propiedades intensivas conocidas son, la densidad, el peso específico, etc.
Propiedades Extensivas: Son las propiedades que si dependen de la cantidad de materia. Por Ejemplo: El volumen, el peso, la longitud, etc. a mayor cantidad de materia, estas aumentan.
Separación de fases: Hay métodos para separar fases en los sistemas heterogéneos. A continuación vamos a detallar algunos.
Decantación: Este método utiliza como principio la diferencia de densidades entre 2 sustancias. Por ejemplo, si queremos separar agua de arena o de otro sólido, vertemos el líquido lentamente de un recipiente a otro quedando la arena en el fondo. En el caso de dos líquidos de distintas densidades e inmiscibles como el agua y el aceite, usamos la ampolla de decantación. Es un dispositivo como muestra la figura. En la parte superior esta un receptáculo para colocar los líquidos. Más abajo tiene un vástago provisto de una mariposa que puede cerrar o abrir el flujo de los líquidos. Para recoger a estos se coloca en la parte inferior un vaso de precipitado. Caerá primero al líquido de mayor densidad que se encuentra en la parte inferior. En este ejemplo, el agua. Cuando el agua caiga por completo cerramos la mariposa y quedara el agua en el vaso y el aceite en la ampolla, ambos líquidos completamente separados

Filtración: Es para separar un sólido de un líquido. Especialmente si el sólido consta de partículas pequeñas difíciles de separar por decantación. Consta de un embudo con un papel de filtro en su interior o algodón algunas veces. El contenido se vierte por la parte superior y por gravedad el líquido ira cayendo y atravesando el filtro mientras que los sólidos quedaran retenidos en el filtro

Tamización: Es una especie de filtración. Pero se usa más para separar sólidos pequeños de sólidos grandes. Por ejemplo arena de canto rodado. Generalmente tienen forma de rectángulo de madera con malla metálica en su interior. Centrifugación: Este método usa la velocidad de centrifugación para acelerar la separación de las partículas sólidas o semisólidas del líquido. Están equipadas de un motor rotatorio, de una tapa y de unos controles para regular la velocidad y el tiempo de centrifugación.

Levigación: No es ya un método muy utilizado. Se lo usaba para recuperar por arrastre de una corriente de agua las partículas que vayan precipitando y siendo recogidas posteriormente. Fue un método practicado para recolectar piedritas de oro.
Imantación: Es justificado cuando hay presencia de metales en el sistema heterogéneo como limaduras de hierro.
Tría: consiste en tomar con pinzas o con la mano las fases sólidas y de tamaño adecuadoque están dispersas en otro sólido o en un líquido.
Flotación: consiste en agregar al sistema formado por dos sólidos, un líquido de peso específico intermedio que no altere las sustancias.
Disolución: permite separar las fases de un sistema material utilizando la diferente solubilidad de las mismas en un disolvente adecuado.
Fraccionamiento de Fases: Luego de la separación de fases a veces es necesario separar los componentesque forman dicha fase o el sistema homogéneo que constituye. Esto se denomina métodos de fraccionamiento.
Destilación: Básicamente hay dos tipos de destilación. La simple y la fraccionada.
Destilación simple: Consiste en la separación de los sólidos de un líquido, que no se pueden separar normalmente por otros métodos. Los sólidos están compuestos de partículas muy pequeñas. El caso más común es cuando tenemos que separar la sal del agua. El dispositivo consta de un balón de destilación donde se coloca el líquido a destilar. Abajo está el mechero que le da calor para que el líquido entre en ebullición. En el balón hay un tapón de goma, el cual está atravesado por un termómetro para controlar la temperatura del proceso. También está adosado un tubo refrigerante. Cuando el vapor asciende al atravesar el refrigerante se vuelve a enfriar, ya que por este circula una corriente de agua en sentido contrario. El vapor frío pasa nuevamente al estado líquido (condensación), recolectándose de a gotas en un frasco colector (puede ser un erlenmeyer). La sal queda como residuo en el fondo del balón.
Esquema del dispositivo:

Destilación fraccionada: Este tipo de destilación es aplicada para separar líquidos de punto de ebullición cercano. Por ejemplo agua y alcohol. A diferencia de la destilación simple se utiliza una columna de fraccionamiento, ésta permite separar los líquidos, ya que el líquido más volátil (el de menor punto de ebullición) arrastra al de mayor punto de ebullición, lo que hace la columna es producir un enfriamiento y que el líquido menos volátil vuelva al balón y el más volátil siga su camino.
Cromatografía: Es una proceso complejo por su variación en cuanto a los distintos tipos de cromatografía. Pero en general podemos decir que consta de dos fases, una móvil y otra estacionaria. La móvil pasa sobre la estacionaria que generalmente es sólida. La móvil es un fluido que puede ser gas o líquido y que transporta a los componentes a separar. En el transcurso del camino recorrido, los distintos componentes de la mezcla se ven separando y asi permiten que sean identificados. Hoy en día hay dispositivos de alta tecnología que acortan los tiempos y lo más importantes son enormemente exactos en la separación.
Cristalización: Algunas sustancias pueden separarse cuando están en solución formando cristales. Esto depende del tipo de solvente usado y de las temperaturas. Los cristales (soluto) empiezan a formarse por la evaporación del solvente.
CUESTIONARIO:
1_ Definir sistema homogéneo y heterogéneo. Dar ejemplos
2_Definir componente, fase e interfase.
3_ Definición y diferencias que existen entre las propiedades intensivas y extensivas?
4_ Explicar y dibujar los distintos métodos separativos de los siguientes sistemas materiales.
A) Limaduras de hierro- arena- sal- telgopor. (en caso de ser necesario agregar agua)
B) Agua-aceite.
 Temas similares
Temas similares» TP3 SISTEMAS MATERIALES
» TP3 SISTEMAS MATERIALES
» TP3 MATERIALES DE LABORATORIO
» TP2 Materiales volumétricos
» TP2 Materiales volumétricos.
» TP3 SISTEMAS MATERIALES
» TP3 MATERIALES DE LABORATORIO
» TP2 Materiales volumétricos
» TP2 Materiales volumétricos.
Página 1 de 1.
Permisos de este foro:
No puedes responder a temas en este foro.|
|
|
